研究者COLUMN
研究者COLUMNでは、化粧品や美容にまつわる最新の研究成果や技術の解説を掲載しています。研究者たちの専門的な視点や自社の研究内容を基に分かりやすく解説した、身近な美の情報が満載です。
2025/08/29
細胞培養加工施設について:細胞培養加工施設(CPC:Cell Processing Center)とは何か
・細胞培養加工施設の目的
再生医療技術を利用した治療は、再生医療等の安全性の確保等に関する法律(安全確保法)、臨床研究法、医療法および医師法に基づいて実施されています1)。治療に使用される再生医療製品には、ヒトや動物の組織を原料とした細胞や培養上清液などがあります。再生医療製品は、最終的に直接ヒトの体内に投与されることから、医薬品や医療機器と同様に、高い安全性と品質が求められます。そのため、特定の基準を満たした細胞培養加工施設(CPC:Cell Processing Center)で製造される必要があります。
本シリーズでは、3回に分けて再生医療製品の一種である特定細胞加工物を製造するためのCPCについて紹介します。本記事では、CPCとは何かをお話します。
細胞培養加工施設とは
機能不全となった組織や臓器に対し、ヒトや動物の細胞などを利用してその機能を回復させる再生医療は、新しい医療技術として注目されてきました。再生医療に用いられる製品の中に、「特定細胞加工物」があります。特定細胞加工物は、ヒトや動物の細胞に培養やその他の加工を施した細胞加工物のうち、再生医療等製品であるもの以外のものを指します(図1)1)。この特定細胞加工物を製造するために、各種法律の基準に従って設置されている施設がCPCです。
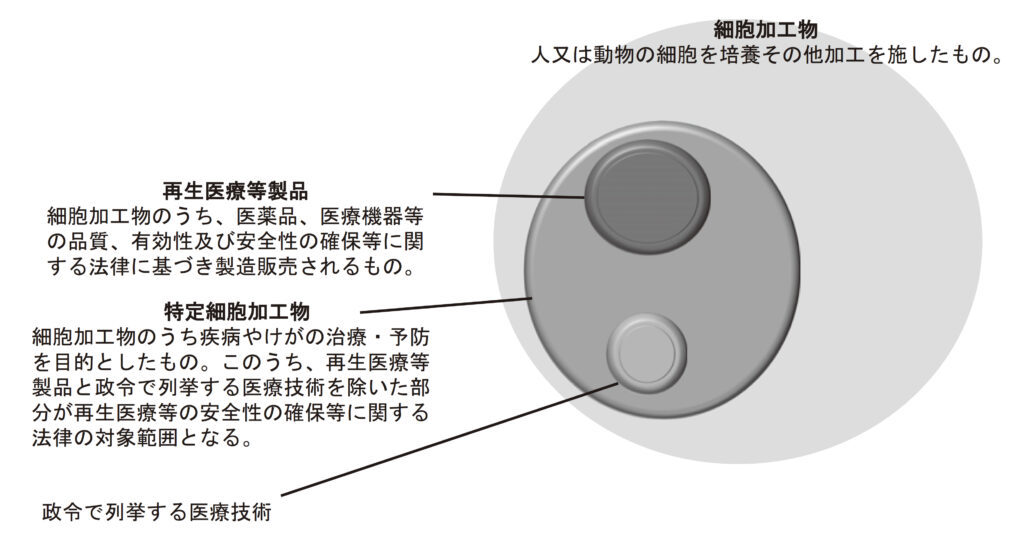
図1. 再生医療等安全性確保法における特定細胞加工物の対象範囲のイメージ1)
出典:再生医療等安全性確保法の下で運営される特定細胞加工物製造施設の施設要件について
細胞培養加工施設の目的
CPCは、安全性や品質を確保した特定細胞加工物を製造することを目的としています。特定細胞加工物は、医師法(自由診療)または臨床研究法に基づいて患者に投与されるものであり、医薬品と同様にその安全性や有効性が確保されている必要があります1)。医療機関が特定細胞加工物を製造する場合、製造物の安全性を保障するため、安全確保法に基づく製造設備の構造設備基準を満たすことが求められます2)。この基準には、製造過程や品質管理、施設内の環境、衛生面など、さまざまな要件が定められています。医療機関は、厚生労働省への届け出を行い、基準に基づく査察を受けた上で、事前に認可を得る必要があります3)。
セルプロジャパン株式会社の取り組み
セルプロジャパン株式会社では、厳しい検査基準をクリアした製品のみを提供しています。製造では製造工程検査と最終製品検査に様々な検査規格を設けており、これらをすべてクリアした製品のみが出荷対象となります。さらに、自社CPCの設置も完了し、現在は施設登録中であり、さらなる品質保証体制の強化を進めています。
参考文献
1)川真田 伸., 再生医療等安全性確保法の下で運営される特定細胞加工物製造施設の施設要件について, Japanese Journal of Transfusion and Cell Therapy, 2021.
2)一瀬 篤., 「再生医療等の安全性の確保等に関する法律について」, ファルマシア, 2014.
3)笠井 泰成., 細胞プロセシングセンター, 日本内科学会雑誌, 2019.

