研究者COLUMN
研究者COLUMNでは、化粧品や美容にまつわる最新の研究成果や技術の解説を掲載しています。研究者たちの専門的な視点や自社の研究内容を基に分かりやすく解説した、身近な美の情報が満載です。
2024/03/18
細胞培養工程を含む最終製品の安全性について:組み換えタンパク質 EGF
目次
・ヒト幹細胞由来培養上清液及びエクソソームの安全性
・組み換えタンパク質: EGF使用のリスク
第六回では、細胞培養培地に添加される代表的なタンパク質である上皮成長因子(EGF)についてお話しします。EGFは、53個のアミノ酸残基からなる1本鎖のタンパク質です。線維芽細胞や内皮細胞の細胞膜上に存在する上皮成長因子受容体(EGFR)を活性化することでシグナルを伝達し、細胞の増殖、生存、分化や血管新生を促す作用があります。上皮組織の増殖を刺激することから、火傷創、糖尿病性潰瘍などをはじめとした創傷治療に広く使用されているだけでなく、老化した線維芽細胞の移動を促進し、ヒアルロン酸とコラーゲン合成を増加させることから化粧品にも利用されています1) 。現在、臨床や研究現場において、人工的に作られたタンパク質である組み換え型EGFタンパク質が利用されています。外因性の組み換え型EGFタンパク質の投与や塗布は、皮膚の再上皮化を促進し、創傷治癒時間の短縮が期待できます。一方で、場合によっては過度に細胞増殖を促進してしまうことも分かっています。このことから、培養工程で使用される組み換え型EGFタンパク質がヒトの身体に入ると目的外の副作用を示す可能性があります。
組み換えタンパク質: EGFを使用するリスク
組み換え型EGFタンパク質は一般的に副作用リスクが低いと考えられており、治療薬として様々な疾患に使用されています。しかしながら、EGFRは生体において広く発現しているため、外因性の組み換え型EGFタンパク質がヒトの身体に入ることで、生体において本来の目的とは異なる反応が生じる可能性があります。組み換え型EGFタンパク質を再生医療製品等に添加する際は、下記のリスクを踏まえて使用を検討する必要があります。
組織の過形成
前臨床安全性試験において、組み換え型EGFタンパク質の長期投与により各種臓器において組織の過形成が生じることが報告されています(図1)2)。ラット、ミニブタを用いた検討では、組み換え型EGFタンパク質投与4週間のうち内臓および皮膚の上皮の過形成、肥大が観察されています。一方で、過剰な上皮細胞の増殖は治療を中止すると改善がみられることから、これらの症状は組み換え型EGFタンパク質の暴露時間と投与容量に依存することも示唆されています。
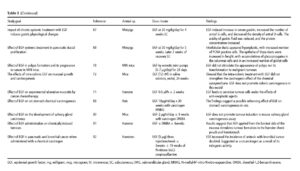
図1. 前臨床安全性試験においてEGF治療で観察された所見2)
セルプロ社製品の特徴
セルプロジャパン社では、最終製品に組み換えタンパク質が漏れ込む可能性を排除するために、独自製法による洗浄工程を設けています。その他、使用する培地や製造方法にも細心の注意を払っています。
【引用】
1) Sun Hye Shin et al., The use of epidermal growth factor in dermatological practice, Int Wound J, 2023.
2) Jorge Berlanga-Acosta et al., Epidermal growth factor in clinical practice – a review of its biological actions, clinical indications and safety implications, Int Wound J. 2009.

